Ürünlerimiz
TĂśKETÄ°CÄ° SAÄžLIÄžI
ALFABEX
TĂśKETÄ°CÄ° SAÄžLIÄžI
| Form: | KapsĂĽl |
| Etkin Madde: | Alfa-Lipoik Asit, Vitamin B Kompleks, Ä°nĂĽlin |
| Ticari Şekil: | 30 KapsĂĽl |
| KÜB: | |
| QR: |  |

BONCAL
TĂśKETÄ°CÄ° SAÄžLIÄžI
| Form: | Tablet |
| Etkin Madde: | Bor,Kalsiyum,Magnezyum,Çinko |
| Ticari Şekil: | 60 Tablet |
| KÜB: | |
| QR: |  |

BRALÄ°NE
TĂśKETÄ°CÄ° SAÄžLIÄžI
| Form: | Film Kaplı Tablet |
| Etkin Madde: | Asetil L-Karnitin ,Ginkgo(Ginkgo biloba), Soya fosfotidilkolin, Vitamin B12 |
| Ticari Şekil: | 30 Tablet |
| KÜB: | |
| QR: |  |

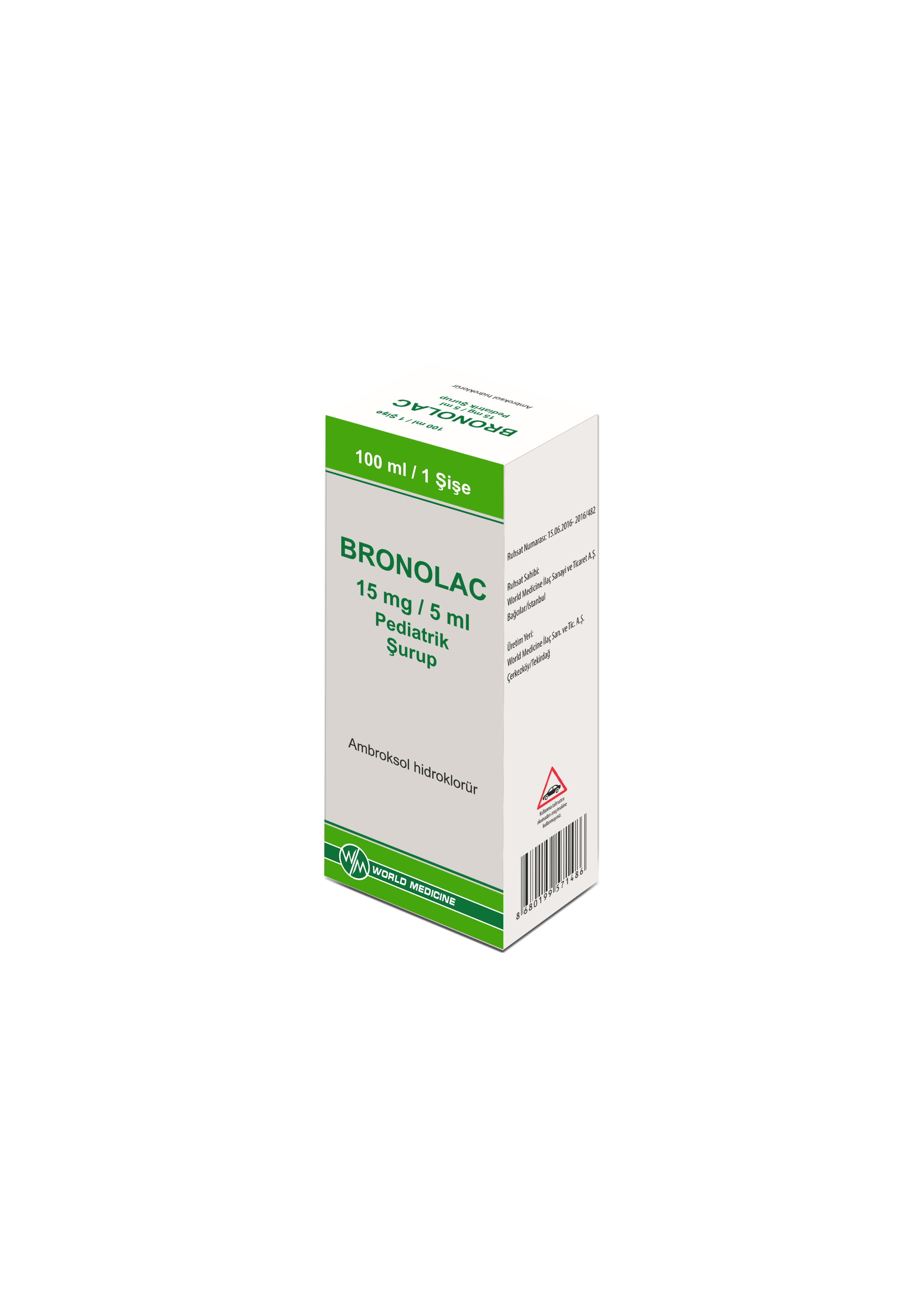
BRONOLAC
TĂśKETÄ°CÄ° SAÄžLIÄžI
| Form: | Ĺžurup |
| Etkin Madde: | Ambroksol HidroklorĂĽr |
| Ticari Şekil: | 15 mg/ 5 ml Pediatrik Ĺžurup |
| KÜB: | |
| QR: |  |
COLLAX
TĂśKETÄ°CÄ° SAÄžLIÄžI
| Form: | Flakon |
| Etkin Madde: | Hidrolize Sığır Kollajen, Tipâ… -â…ˇ , Hyaluronik Asit |
| Ticari Şekil: | 30 ml |
| KÜB: | |
| QR: |  |

FOLÄ°NTRA
TĂśKETÄ°CÄ° SAÄžLIÄžI
| Form: | Dilaltı Tablet |
| Etkin Madde: | Folik Asit, B6 Vitamini, B12 Vitamini, Ä°yot |
| Ticari Şekil: | 30 Dil Altı Tablet |
| KÜB: | |
| QR: |  |

HEPANERA
TĂśKETÄ°CÄ° SAÄžLIÄžI
| Form: | KapsĂĽl |
| Etkin Madde: | Devedikeni Ekstresi, Karahindiba Ekstresi, Kolin, Vitamin E ve Alfa Lipoik Asit |
| Ticari Şekil: | 60 KapsĂĽl |
| KÜB: | |
| QR: |  |

Ä°NTRACAS
TĂśKETÄ°CÄ° SAÄžLIÄžI
| Form: | Cilt Masaj Kremi |
| Etkin Madde: | At Kestanesi, Arnika Yağı |
| Ticari Şekil: | 75 ml Krem |
| KÜB: | |
| QR: |  |

Ä°NTRACÄ°S
TĂśKETÄ°CÄ° SAÄžLIÄžI
| Form: | KapsĂĽl |
| Etkin Madde: | BĂĽyĂĽk Meyveli Vaksiniyum Meyve Ekstresi |
| Ticari Şekil: | 30 KapsĂĽl |
| KÜB: | |
| QR: |  |

Ä°NTRAK2
TĂśKETÄ°CÄ° SAÄžLIÄžI
| Form: | Flakon |
| Etkin Madde: | Hidrolize Sığır Kollajeni, K2 Vitamini |
| Ticari Şekil: | 30 ml 30 flakon |
| KÜB: | |
| QR: |  |

Ä°NTRAMAG
TĂśKETÄ°CÄ° SAÄžLIÄžI
| Form: | Tablet |
| Etkin Madde: | Magnezyum Sitrat, Magnezyum Malat, Magnezyum Bisglisinat,Magnezyum Taurat |
| Ticari Şekil: | 30+30 Tablet |
| KÜB: | |
| QR: |  |

Ä°NTRAMAX
TĂśKETÄ°CÄ° SAÄžLIÄžI
| Form: | Flakon |
| Etkin Madde: | Hidrolize Sığır Kollajeni, D Vitamini |
| Ticari Şekil: | 30 ml 30 flakon |
| KÜB: | |
| QR: |  |

Ä°NTRASAW
TĂśKETÄ°CÄ° SAÄžLIÄžI
| Form: | KapsĂĽl |
| Etkin Madde: | Saw Palmetto + Pumpkin Seed |
| Ticari Şekil: | 30 KapsĂĽl |
| KÜB: | |
| QR: |  |

Laxoline
TĂśKETÄ°CÄ° SAÄžLIÄžI
| Form: | SaĹźe |
| Etkin Madde: | Sinameki Ekstresi, Karnıyarık Ekstresi, Arap Zamkı |
| Ticari Şekil: | 15 SaĹźe/ 5 gr |
| KÜB: | |
| QR: |  |

PROSTROLANE
TĂśKETÄ°CÄ° SAÄžLIÄžI
| Form: | Flakon |
| Etkin Madde: | Hyaluronik Asit + 5 Peptit |
| Ticari Şekil: | 30 mg/2ml |
| KÜB: | |
| QR: |  |

SPERRA
TĂśKETÄ°CÄ° SAÄžLIÄžI
| Form: | KapsĂĽl |
| Etkin Madde: | Tribulus Terrestris (Demir Dikeni) |
| Ticari Şekil: | 60 KapsĂĽl |
| KÜB: | |
| QR: |  |

